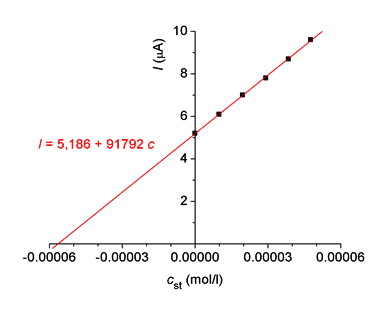
Řešenía) Výpočet koncentrace kyseliny askorbové podle vztahu (VII.16) pro přídavky standardu 0,1 až 0,3 ml 0,001 mol·l-1: c1 = c2 = 5,361·10-5 mol·l-1 c3 = 5,504·10-5 mol·l-1 b) Výpočet koncentrace kyseliny askorbové podle (16a) pro přídavky standardu 0,4 a 0,5 ml 0,001 mol·l-1: c4 = cs · c5 = 5,328·10-5 mol·l-1 Průměr výsledků: c1-5 = 5,402·10-5 mol·l-1 měřených roztoků m = 5,402·10-5 · 176,13 = 9,514 mg·l-1 (koncentrace 10 krát zředěného analytu v měrné nádobce) c) rovnice regresní přímky závislosti I = f(cst): I = 5,186 + 91792 c.
Koncentrace vzorku se rovná absolutní hodnotě průsečíku regresní přímky s osou x (hodnotě |c| pro I = 0): 0 = 5,186 + 91792 c |c| = 5,650·10-5 mol·l-1: m = 9,951 mg·l-1 (koncentrace 10 krát zředěného analytu v měrné nádobce) Průměrný obsah kyseliny askorbové v nápoji je 10 mg/100 ml. | ||
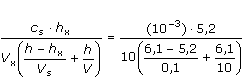 = 5,411·10-5 mol·l-1
= 5,411·10-5 mol·l-1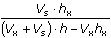 = 10-3 ·
= 10-3 · 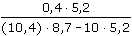 = 5,405·10-5 mol·l-1
= 5,405·10-5 mol·l-1