| |
| |
- Příklad VII.3.1




- Jakou hodnotu bude mít střední limitní proud v roztoku 2·10–4 M-Pb2+?
Použijte několik možných variant rozměrů veličin. Zjištěné parametry: D =
1,01·10–5 cm2·s–1, mh =
2 mg·s–1, t = 4 s
- Příklad VII.3.2




- Vypočtěte difúzní koeficient elektroaktivní látky, když roztok s koncentrací 2,4·10-3
mol·l-1 poskytl střední difúzní proud 15,80 μA. Další parametry: z = 2,
mh = 2,6 mg·s-1, doba Hg-kapky t = 3,2 s.
- Příklad VII.3.3




- Organická látka byla polarograficky redukována. Při koncentraci 2·10-4
mol·l-1 vznikla vlna středního limitního proudu 1,98 μA, když byla užita kapilára
s parametry: mh = 3,4 mg·s-1, t = 2,7 s. Difúzní
koeficient sloučeniny v daném elektrolytu byl D = 9·10-6
cm2·s-1. Kolik elektronů se zúčastnilo elektrodové redoxní reakce?
- Příklad VII.3.4




- Při korigované výšce rtuťového sloupce h1 = 48,6 cm (h1 =
hm – hz) byl zaznamenán střední proud 3,12 μA. Vypočítejte
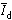 při h2 = 71,1 cm. při h2 = 71,1 cm.
- Příklad VII.3.5




- Rozhodněte, zda polarografický proud je řízen difúzí!
| h [cm] | 90 | 80 | 70 | 50 | 30
| | h1/2 | 9,487 | 8,944 | 8,367 | 7,071 | 5,477
| | I [μA] | 6,07 | 5,78 | 5,48 | 4,61 | 3,50
|
- Příklad VII.3.6




- Při výšce rtuťového sloupce h = 64 cm byl naměřen střední limitní proud redukce
Cd2+-iontů 12,6 μA. Jak velké budou proudy při výškách h: 36 cm, 49 cm, 81 cm,
100 cm a 121 cm?
- Příklad VII.3.7




- Vypočtěte koncentraci Tl+-iontů v 0,1 molárním roztoku KCl. Použijte absolutní metodu,
jsou-li známy následující veličiny: D = 1,74·10-5
cm2·s-1, mh = 2,10 mg·s-1,
t = 3,6 s, střední limitní difúzní proud 4,61 μA.
- Příklad VII.3.8




- Navážka 2,6024 g látky obsahující nikl byla rozpuštěna a zředěna na 250 ml. K polarografické analýze
bylo odebráno 10 ml vzorku, přidáno 10 ml elektrolytu a byla zaznamenána vlna Ni2+ h
= 8,2 mm. Stejným postupem byl připraven referenční roztok z navážky 1,4773 g standardu s obsahem 0,520
% Ni a stejným postupem byl polarografován – 10 ml roztoku standardu poskytlo vlnu 55,5 mm. Jaký je
procentuální obsah Ni ve vzorku? Mr(Ni) = 58,69.
- Příklad VII.3.9




- Roztok redukovatelného kovového iontu koncentrace 0,001 mol·l-1 poskytuje
v základním elektrolytu střední limitní proud 6,0 μA. Konstanta difúzního proudu J = 35
A·mol–1·cm3·g–2/3·s1/2 a
průtoková rychlost rtuti mh = 50 mg·s–1. Jaká je doba rtuťové kapky?
- Příklad VII.3.10




- Jaký je relativní úbytek látkového množství Pb2+-iontů v procentech po 20 minutové elektrolýze
na rtuťové kapající elektrodě? Elektrolýza byla provedena při potenciálu limitního proudu. Parametry:
mh = 2 mg·s–1, t = 3 s, D = 9·10–6
cm2·s–1, cPb = 0,001 mol·l–1,
V = 10 ml.
- Příklad VII.3.11




- Za jakou dobu poklesne 0,01 molární koncentrace Pb2+ o 1 % v 10 ml roztoku, jestliže článkem
se rtuťovou kapající elektrodou bude protékat limitní difúzní proud? Změnu proudu vlivem změny
koncentrace zanedbejte. Elektrochemická reakce: Pb2+ + 2e
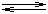 Pb; průtoková rychlost rtuti
mh = 2,4 mg·s-1, doba kapky t = 3 s, difúzní koeficient
Pb2+: D = 9·10–6 cm2·s-1. Pb; průtoková rychlost rtuti
mh = 2,4 mg·s-1, doba kapky t = 3 s, difúzní koeficient
Pb2+: D = 9·10–6 cm2·s-1.
- Příklad VII.3.12




- Jaká je látková koncentrace roztoku hydrochinonu, jestliže vzorek 10 krát zředěný poskytl střední
limitní proud 27,9 μA? Proud roztoku standardu 1·10–4 mol·l-1
měl hodnotu 17,5 μA.
- Příklad VII.3.13




- Vzorek zinkové rudy 1,0 g byl rozpuštěn a po doplnění objemu na 50 ml bylo stanoveno kadmium. Hodnota
limitního proudu Id = 11,0 μA. Charakteristiky kapiláry: mh
= 1,50 mg·s–1, t = 4 s. Standardní roztok CdSO4 byl
3·10–4 molární a vykazoval proud 8,3 μA při použití jiné kapiláry, jejíž konstanty
byly: mh = 1,37 mg·s–1, t = 3,9 s. Jaký je hmotnostní
obsah kadmia v rudě? Mr(Cd) = 112,4
- Příklad VII.3.14




- Empiricky zjištěná konstanta difúzního proudu pro olovo při průtokové rychlosti mh
= 32,5 mg·s–1 a době kapky 4,3 s má hodnotu 8,25
A·mol–1·cm3·g–2/3·s1/2. Difúzní
limitní proud Pb2+ v roztoku neznámé koncentrace má hodnotu 4,3 μA. Jaká je koncentrace
olova ve vzorku?
- Příklad VII.3.15




- Při polarografickém stanovení Pb2+-iontů ve vzorku, který současně obsahoval
Cd2+-ionty o koncentraci 0,001 mol·l-1, byl odečten střední limitní proud
4,70 μA pro ionty olovnaté a 8,61 μA pro ionty kademnaté. Elektrolytem byl 0,1M-KCl. Konstanty
difúzního proudu Pb2+- a Cd2+-iontů v 0,1M-KCl: JPb = 3,85
g–2/3·cm3·s1/2·A·mol–1,
JCd = 3,53 g–2/3·cm3·s1/2·A·mol–1.
Jaká je látková koncentrace olovnatých iontů?
- Příklad VII.3.16




- Vzorek 15 ml roztoku s neznámou koncentrací Mn2+ poskytl proud 5,65 μA. Do tohoto roztoku
byl přidán 1 ml standardu o koncentraci 5·10-3 mol·l-1
Mn2+. Ze záznamu odečtený proud měl hodnotu 9,51 μA. Jaká je koncentrace Mn2+
v původním vzorku?
- Příklad VII.3.17




- Vzorek 1,0 g slitiny hořčíku a zinku byl rozpuštěn v HCl a po úpravě doplněn na objem 250 ml. K 10 ml
tohoto roztoku, poskytujícího vlnu výšky 37 mm, byly přidány 2 ml 5·10–3
mol·l-1 standardního ZnSO4. Výška vlny pak byla 63,0 mm. Jaký je obsah
zinku? Mr = 65,38
- Příklad VII.3.18




- Polarografická analýza vzorku 10 ml olovnaté soli (včetně elektrolytu) poskytla vlnu 5,60 μA.
Po přídavku 1 ml 1·10-3 mol·l-1 standardního roztoku Pb2+
vlna vzrostla na hodnotu 12,2 μA. Jaká je koncentrace Pb2+ ve vzorku?
- Příklad VII.3.19




- Kyselinu askorbovou lze voltametricky stanovit anodickou oxidací. Reversibilní elektrodová reakce
probíhá přes primární meziprodukt (B), který je dále chemickou reakcí přeměněn na elektrochemicky
inaktivní kyselinu dehydroaskorbovou (Y):
Vzorek 1 ml ovocného nápoje byl v elektrochemické nádobce upraven octanovým pufrem na optimální
pH (~4,7), doplněn vodou na objem 10 ml, odvzdušněn a analyzován. Proudový pík měl hodnotu 5,2 μA.
Poté bylo ke vzorku přidáno (celkem 5x) vždy po 0,1 ml roztoku standardu koncentrace
1·10-3 mol·l-1. Píky po jednotlivých přídavcích vykazovaly
následující hodnoty: 6,1 – 7,0 – 7,8 – 8,7 – 9,6 μA. Vypočtěte průměrný hmotnostní obsah (mg)
kyseliny askorbové ve 100 ml nápoje. Mr = 176,13.
- Příklad VII.3.20




- Vzorek 1 g slitiny byl po rozpuštění zředěn na objem 100 ml. K podílu 0,1 ml roztoku bylo
ve voltametrické nádobce přidáno 5 ml amoniakálního pufru a 4,9 ml vody. Z voltamogramu byly odečteny
dvě proudové hodnoty: 35 mm (INi) a 78 mm (IZn). Pak byl k témuž
roztoku přidán standard Zn2+ v množství 0,1 ml 0,001 mol·l-1 a výška vlny
zinku se zvýšila na 108 mm. Jaký je procentový obsah niklu a zinku ve slitině? Pro difúzní koeficienty
v amminkomplexech platí DNi ≈ DZn. Mr(Ni) =
58,69; Mr(Zn) = 65,39
- Příklad VII.3.21




- K jednomu ze dvou roztoků, připravených souběžně rozpuštěním 1,0 g hliníkové slitiny, bylo přidáno 20 ml
0,01M-NiSO4. Po úpravě roztoku byly objemy doplněny na 100 ml a podrobeny polarografické
analýze na nikl. Vlna Ni2+-iontů ve vzorku měla výšku 37,5 mm, vlna s přídavkem byla 60 mm
vysoká. Jaký je obsah niklu ve slitině? Mr = 58,69
- Příklad VII.3.22




- Vzorek 1,000 g zinkové rudy byl rozpuštěn a doplněn na objem 100 ml. K podílu 20 ml roztoku byl přidán
základní elektrolyt a voda do objemu 100 ml a roztok byl podroben voltametrické analýze – výška píku
byla 29,0 mm. Ke druhému stejnému podílu vzorku bylo přidáno 15 ml standardu 1·10-3
M-Cd2+-iontů, elektrolyt a voda rovněž do objemu 100 ml. Proudový pík dosáhl hodnoty 62,0 mm.
Jaký byl procentový obsah kadmia v rudě? Mr(Cd) = 112,4
- Příklad VII.3.23




- Obsah As(III) ve vodě může být stanoven metodou DPP v 1M HCl. Scan polarizačního potenciálu se provádí
rychlostí 5 mV/s, Ep = -0,44 V (vs. SKE) je projevem redukce As(III) na
As(0). Kalibrační závislost byla sestrojena z následujících dat:
| cAs [μmol·l-1] | 1 | 3 | 6 | 9
| | Ip [μA] | 0,298 | 0,947 | 1,830 | 2,720
|
Jaká je koncentrace As(III) ve vzorku vody, jestliže DPP-pík je 1,37 μA?
- Příklad VII.3.24




- Vzorek 1,0 g obsahující železo byl rozpuštěn a doplněn na 100 ml. Podíl 20 ml byl polarografován –
limitní difúzní proud železa měl hodnotu 42,0 μA. Ke zbývající části (80 ml) bylo přidáno 5,00 ml
0,01M-(NH4)2Fe(SO4)2 a podíl 20 ml takto upraveného roztoku
poskytl limitní proud 58,5 μA. Jaká je látková koncentrace Fe2+-iontů v původním roztoku?
- Příklad VII.3.25




- Roztok kademnaté soli poskytl střední limitní proud 48,6 μA. Když byl ke vzorku přidán stejný objem
standardu koncentrace 5,50·10–4 mol·l-1, proud měl hodnotu
61,5 μA. Jaká je látková koncentrace a hmotnostní obsah kadmia ve 100 ml analyzovaného roztoku?
Mr(Cd) = 112,41
- Příklad VII.3.26




- Obsah mědi ve vzorku vody byl stanoven anodickou stripping voltametrií (ASV) za použití metody
standardního přídavku. Analyzováno bylo 50 ml vzorku, který poskytl proud 0,886 μA. Pak bylo
do roztoku v nádobce přidáno 5,00 μl roztoku standardu, obsahujícího 10,0 ppm Cu. Následně zjištěný
proud měl hodnotu 2,52 μA. Jaký obsah (ppm) Cu2+ je v analyzované vodě?
- Příklad VII.3.27




- Diferenčně pulzní analýza směsi In3+ a Cd2+ iontů v 0,1M-HCl je komplikována
překrýváním vln. Potenciál píku india Ep(In) = -0,557 V, kadmia
Ep(Cd) = -0,597 V. Standard In3+ koncentrace 6,967·10-6
mol·l-1 (tj. 0,800 ppm) poskytl proud 200,5 μA při potenciálu –0,557 V a 87,5 μA
při –0,597 V. Standard Cd2+ koncentrace 7,055·10-6 mol·l-1
(tj. 0,793 ppm) při potenciálu –0,557 V poskytl pík 58,5 μA, resp. 128,5 μA při –0,597 V. Jaká
bude koncentrace jednotlivých iontů, jestliže DPP-pík směsi má hodnotu 167,0 μA, resp. 99,5 μA
při potenciálu –0,557, resp. –0,597 V?
- Příklad VII.3.28




- Diferenční pulsní voltametrie byla použita ke stanovení olova, thalia a india ve vzájemné směsi. Protože
proudové píky Pb2+, Tl+ a In3+ se částečně překrývají, je nezbytná
jejich paralelní analýza. Proudové píky (μA) standardního roztoku směsi iontů a vzorku byly změřeny
při potenciálech -0,385 V (Pb2+), -0,455 V (Tl+) a -0,557 V (In3+)
a jsou uvedeny v tabulce. Jaká je koncentrace jednotlivých iontů ve vzorku?
| Analyt | Koncentrace μg/ml | Ip [μA]
při –0,385 V | Ip [μA]
při –0,455 V | Ip [μA]
při –0,557 V
| | Pb2+ | 1,0 | 26,1 | 2,9 | 0
| | Tl+ | 2,0 | 7,8 | 23,5 | 3,2
| | In3+ | 0,4 | 0 | 0 | 22,9
| | vzorek | | 60,6 | 28,8 | 54,1
|
- Příklad VII.3.29




- Roztok obsahuje směs iontů Fe3+ a Fe2+. Při potenciálu negativnějším než +0,4 V
(vs. SCE) je redukováno Fe(III) na Fe(II) a při –1,5 V probíhá redukce Fe(II) na Fe(0).
Při 0 V byl zaznamenán proud 12,5 μA, limitní proud redukční vlny při negativním potenciálu má
hodnotu 30 μA. Zjistěte poměr koncentrací iontových forem železa v roztoku!
|
| | |
|
|