|
- Příklad 7.62




- S ohledem na iontovou sílu roztoku vypočítejte rozpustnost hydroxidu hořečnatého: a) v jeho
nasyceném vodném roztoku, b) v 0,1M-NaOH, c) v 0,01M-Mg(NO3)2!
Výsledky srovnejte s odpovídajícími hodnotami bez vlivu iontové síly!
Řešení Rozpustnost hydroxidu hořečnatého je ovlivněna prostředím – typem rozpouštědla a množstvím indiferentních iontů i iontů, tvořících sraženinu. Ks = 1,12·10–11 = 10–10,951a) Rozpustnost Mg(OH)2 ve vodě: V nasyceném vodném roztoku platí: [Mg(OH)2] = [Mg2+] = c = 1/2[OH–]Součin rozpustnosti definovat lze podle (6), resp. (7): K s,c = c·(2c) 2 = 4 c 3[Mg(OH)2] = [Mg2+] = c = 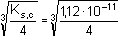 = 1,41·10–4 mol·l-1 = 1,41·10–4 mol·l-1 Iontovou sílu roztoku tvoří Mg2+ a OH--ionty:I = 1/2(1,409·10–4·22 + 2·1,409·10–4·12) = 4,23·10–4 což je hodnota poměrně malá, takže ovlivnění rozpustnosti sraženiny iontovou sílou roztoku je nevýznamné, a tedy zanedbatelné ([Mg(OH)2] = 1,41·10–4 mol·l-1). b) Rozpustnost Mg(OH)2 v 0,1M-NaOH:Součin rozpustnosti, a tím rozpustnost Mg(OH)2 podle (1) a (10) bez vlivu iontové síly roztoku, bude definovánKs = 1,12·10–11 = [Mg2+]o · (0,1)2 [Mg2+]o = [Mg(OH)2]o = 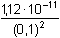 = 5,89·10–9 mol·l-1 = 5,89·10–9 mol·l-1 Iontovou sílu roztoku tvoří 0,1M-NaOH, který je v přebytku; I = 0,1Pro výpočet rozpustnosti sraženiny v daném prostředí je třeba použít koncentrační součin rozpustnosti, vypočtený např. podle rovnice (3): log fMg2+ = –0,509·22·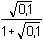 = –0,509·22·0,240 = –0,4886 = –0,509·22·0,240 = –0,4886  fMg2+ = 0,3246 fMg2+ = 0,3246log f OH- = –0,509·1 2· 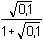 = –0,509·1 2·0,240 = –0,1222  f OH- = 0,7584 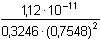 = 6,056·10–11 = 6,056·10–11 nebo s využitím středního aktivitního koeficientu sloučeniny:log f± = –0,509·1·2·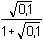 = –0,509·1·2·0,240 = –0,2443 = –0,509·1·2·0,240 = –0,2443  f± = 0,5697 f± = 0,5697K s,c = 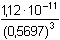 = 6,057·10 –11 Rozpustnost hydroxidu hořečnatého v 0,1M-NaOH pak bude podle vztahu (10):[Mg(OH)2] = 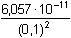 = 6,057·10-9 mol·l–1 ≈ 6,06·10–9 mol·l–1 = 6,057·10-9 mol·l–1 ≈ 6,06·10–9 mol·l–1 nebo podle vztahu (14) s využitím aktivitních koeficientů iontů OH– a Mg2+:[Mg2+]o = [Mg(OH)2]o = 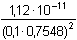 = 1,966·10–9 mol·l–1 = 1,966·10–9 mol·l–1log [Mg(OH)2] = log 1,966·10–9 + (–log fMg2+) = –8,7064 + 0,4886 = –8,2178 [Mg(OH)2] = 6,056·10-9 mol·l–1 ≈ 6,06·10–9 mol·l–1 nebo podle vztahu (14) s využitím středního aktivitního koeficientu: f± = 0,5697[Mg2+]o = [Mg(OH)2]o = 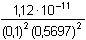 = 3,4508·10–9 mol·l–1 = 3,4508·10–9 mol·l–1log [Mg(OH)2] = log 3,4508·10–9 + (–log f±) = –8,4621 + 0,2443 = –8,2178 [Mg(OH)2] = 6,056·10-9 mol·l–1 ≈ 6,06·10–9 mol·l–1 Použije-li se rovnice (5) pro výpočet Ks,c, rozpustnost vykazuje drobnou odchylku od předchozího výsledku, způsobenou číselnou veličinou 0,5 místo 0,509 v Debye-Hückelově rovnici (viz řešení c)). c) Rozpustnost Mg(OH)2 v 0,01M-Mg(NO3)2: Součin rozpustnosti, a tím rozpustnost Mg(OH)2 podle (1) a (12b) bez vlivu iontové síly roztoku, bude definovánKs = 1,12·10–11 = 0,01 · [OH-]o2 [OH–]o = 2 [Mg(OH)2]o = 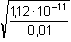 = 3,347·10–5 mol·l–1 = 3,347·10–5 mol·l–1[Mg(OH)2]o = 1/2[OH–] = 1,673·10–5 mol·l–1 Iontovou sílu roztoku tvoří disociovaná sloučenina Mg(NO3)2, která je v přebytku:I = 1/2(0,01·22 + 2·0,01·12) = 0,03 Pro výpočet rozpustnosti sraženiny v daném prostředí je třeba použít koncentrační součin rozpustnosti, vypočtený např. podle rovnice (3):log fMg2+ = –0,509·22·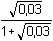 = -0,509·22·0,148 = –0,3013 = -0,509·22·0,148 = –0,3013  fMg2+ = 0,4996 fMg2+ = 0,4996log f OH- = –0,509·1 2· 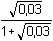 = -0,509·1 2·0,148 = –0,0753  f OH- = 0,8408 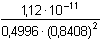 = 3,171·10–11 = 10-10,499 = 3,171·10–11 = 10-10,499 nebolog f± = –0,509·1·2·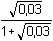 = -0,509·1·2·0,148 = –0,1507 = -0,509·1·2·0,148 = –0,1507  f± = 0,7069 f± = 0,7069K s,c = 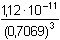 = 3,171·10 –11 = 10 -10,499 Rozpustnost hydroxidu hořečnatého v 0,01M-Mg(NO3)2 pak bude podle vztahu (10):[Mg(OH)2] = 1/2[OH–] = 1/2 · 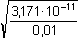 ≈ 2,82·10–5 mol·l–1 ≈ 2,82·10–5 mol·l–1 nebo podle vztahu (14) s využitím aktivitních koeficientů iontů Mg2+ a NO3-:[Mg(OH)2]o = 1/2[OH–]o = 1/2 · 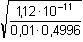 = 2,367·10–5 mol·l–1 = 2,367·10–5 mol·l–1log [Mg(OH)2] = log 2,367·10–5 + (–log fOH-) = –4,6257 + 0,0753 = –4,5504 [Mg(OH)2] = 2,816·10-5 mol·l–1 ≈ 2,82·10–5 mol·l–1 Tentýž výsledek se obdrží i v případě využití středního aktivitního koeficientu podle tvaru rovnice (14):[Mg(OH)2]o = 1/2[OH–]o = 1/2 · 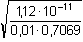 = 1,990·10–5 mol·l–1 = 1,990·10–5 mol·l–1log [Mg(OH)2] = log 1,990·10–5 + (–log f±) = –4,7011 + 0,1507 = –4,5504 [Mg(OH)2] = 2,816·10-5 mol·l–1 ≈ 2,82·10–5 mol·l–1 Použije-li se rovnice (5) pro výpočet Ks,c, rozpustnost vykazuje drobnou odchylku od předchozího výsledku, způsobenou číselnou veličinou 0,5 místo 0,509 v Debye-Hückelově rovnici, tedypKs,c = 10,951 – 3 · 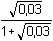 = 10,951 – 3·0,148 = 10,507 = 10,951 – 3·0,148 = 10,507  Ks,c = 3,11·10–11 Ks,c = 3,11·10–11[Mg(OH) 2] = 1/2[OH –] = 1/2 · 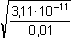 = 2,79·10–5 mol·l –1 Zpět
| | |
| |




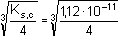 = 1,41·10–4 mol·l-1
= 1,41·10–4 mol·l-1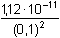 = 5,89·10–9 mol·l-1
= 5,89·10–9 mol·l-1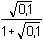 = –0,509·22·0,240 = –0,4886
= –0,509·22·0,240 = –0,4886  fMg2+ = 0,3246
fMg2+ = 0,3246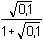 = –0,509·12·0,240 = –0,1222
= –0,509·12·0,240 = –0,1222  fOH- = 0,7584
fOH- = 0,7584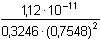 = 6,056·10–11
= 6,056·10–11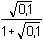 = –0,509·1·2·0,240 = –0,2443
= –0,509·1·2·0,240 = –0,2443  f± = 0,5697
f± = 0,5697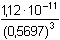 = 6,057·10–11
= 6,057·10–11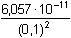 = 6,057·10-9 mol·l–1 ≈ 6,06·10–9 mol·l–1
= 6,057·10-9 mol·l–1 ≈ 6,06·10–9 mol·l–1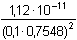 = 1,966·10–9 mol·l–1
= 1,966·10–9 mol·l–1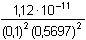 = 3,4508·10–9 mol·l–1
= 3,4508·10–9 mol·l–1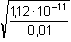 = 3,347·10–5 mol·l–1
= 3,347·10–5 mol·l–1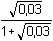 = -0,509·22·0,148 = –0,3013
= -0,509·22·0,148 = –0,3013  fMg2+ = 0,4996
fMg2+ = 0,4996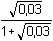 = -0,509·12·0,148 = –0,0753
= -0,509·12·0,148 = –0,0753  fOH- = 0,8408
fOH- = 0,8408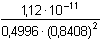 = 3,171·10–11 = 10-10,499
= 3,171·10–11 = 10-10,499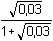 = -0,509·1·2·0,148 = –0,1507
= -0,509·1·2·0,148 = –0,1507  f± = 0,7069
f± = 0,7069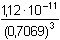 = 3,171·10–11 = 10-10,499
= 3,171·10–11 = 10-10,499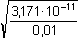 ≈ 2,82·10–5 mol·l–1
≈ 2,82·10–5 mol·l–1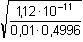 = 2,367·10–5 mol·l–1
= 2,367·10–5 mol·l–1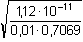 = 1,990·10–5 mol·l–1
= 1,990·10–5 mol·l–1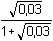 = 10,951 – 3·0,148 = 10,507
= 10,951 – 3·0,148 = 10,507  Ks,c = 3,11·10–11
Ks,c = 3,11·10–11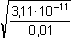 = 2,79·10–5 mol·l–1
= 2,79·10–5 mol·l–1